南湖新闻网讯(通讯员 隋保坤)近日,国际学术期刊 Genome Biology在线报道了我校狂犬病研究团队赵凌教授课题组题为 “A novel antiviral lncRNA, EDAL, shields a T309 O-GlcNAcylation site to promote EZH2 lysosomal degradation” 的最新研究成果。论文揭示了多种嗜神经病毒能够在神经元中诱导表达长链非编码RNA EDAL (lncRNA EDAL),通过调控宿主组蛋白甲基转移酶EZH2的降解来促进抗病毒多肽PCP4L1表达从而抑制病毒增殖的分子机制,为进一步研究嗜神经病毒与宿主相互作用的机制提供了新思路。
狂犬病是由狂犬病毒引起的一种感染宿主中枢神经系统重要人兽共患病,一旦发病死亡率接近100%。狂犬病毒为严格的嗜神经病毒,当狂犬病毒进入机体后会沿着末梢神经系统潜入中枢神经系统,迅速感染脑内神经元并造成不可逆的神经损伤。宿主中枢神经系统中是否存在能够有效抵抗狂犬病毒和其他嗜神经病毒入侵与感染的宿主因子是科学家关注的焦点。
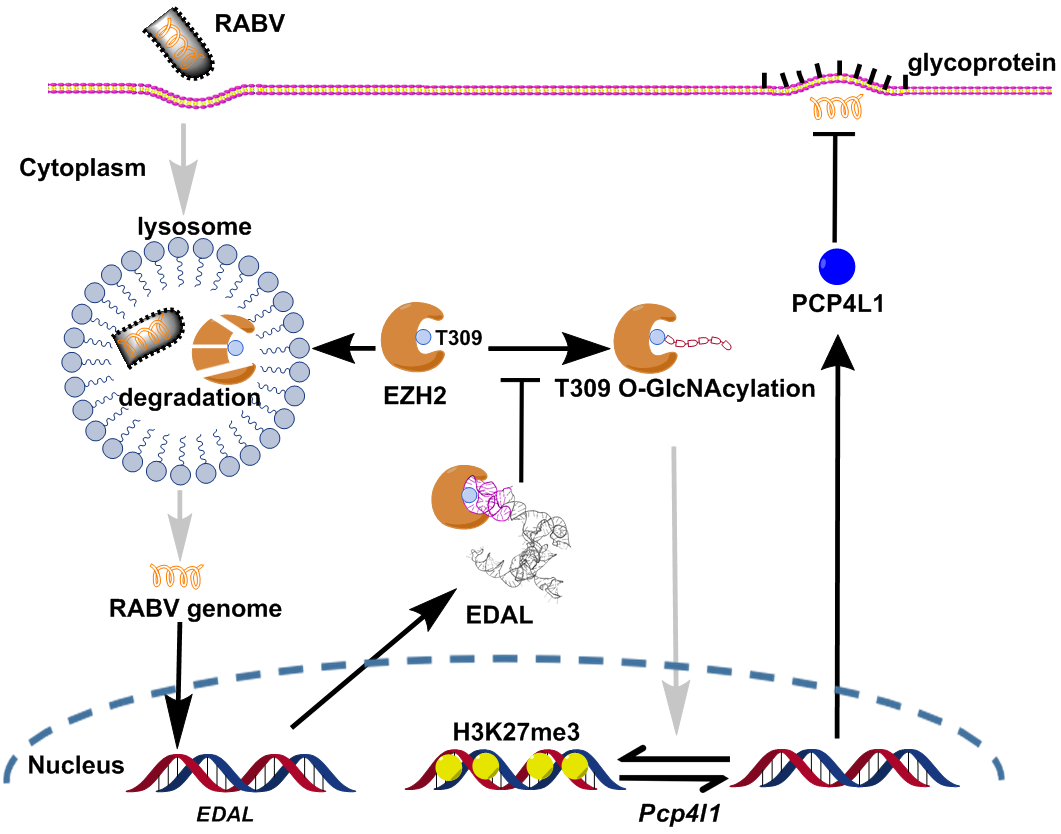
近年的研究表明lncRNA在多种生命过程中发挥着极为重要的功能,而在中枢神经系统中的lncRNA是否具有抑制嗜神经病毒感染的功能目前鲜有报道。本研究作者利用狂犬病毒作为研究模型,在感染神经元细胞系N2a细胞后通过RNA-seq的技术手段找到了大量差异表达的lncRNA,并通过表达lncRNA抑制病毒的筛选实验发现狂犬病毒诱导产生的一种全新的lncRNA EDAL能够显著抑制狂犬病毒的增殖,进一步研究发现EDAL能够显著抑制多种嗜神经病毒,包括水疱性口炎病毒(VSV)、森林脑炎病毒(SFV)和单纯疱疹病毒(HSV-1)等。作者利用狂犬病毒反向遗传操作系统在狂犬病毒基因组中插入EDAL后感染小鼠,发现与对照组相比过表达EDAL能够显著降低狂犬病毒在小鼠体内的致病性。
lncRNA EDAL的诱导产生及其抑制狂犬病毒增殖的模式图
深入研究表明EDAL可以与组蛋白甲基转移酶EZH2特异性结合并诱导EZH2通过溶酶体途径降解。通过截短过表达实验发现EDAL的5’端98-153 nt是诱导EZH2降解以及发挥抑制病毒功能的关键区段。作者通过三维结构模拟预测了EDAL 98-153 nt与EZH2的结合位点,再经过点突变、截短过表达、RNA pull-down以及EMSA等大量生化验证后发现EDAL 98-153 nt与EZH2 N端1-337aa结合,并阻碍EZH2 T309位的O-GlcNAcylation修饰从而介导EZH2通过溶酶体途径降解,最终造成细胞内整体的H3K27me3水平降低。进一步通过ChIP-seq筛选发现EDAL诱导的EZH2降解会造成抗病毒多肽PCP4L1启动子处的H3K27me3水平显著降低,从而促进其表达增加并最终抑制多种嗜神经病毒增殖。
该研究通过RNA-seq的方法筛选出一条具有抗病毒功能的全新lncRNA EDAL。EDAL通过调控宿主甲基转移酶EZH2的翻译后修饰来调控其降解而影响到组蛋白H3K27me3的水平并影响抗病毒多肽PCP4L1的转录表达。颠覆了此前EZH2只能非特异性结合lncRNA的传统观点,揭示了EZH2中能够特异性结合lncRNA的新位点,为抗病毒、抗肿瘤药物的设计提供了新思路。
据悉,该研究是狂犬病研究团队在发现了狂犬病毒新的模式识别受体TLR7(Journal of Virology, 2020a)和宿主限制性因子IIGP1(Journal of Virology, 2020b),发掘了影响狂犬疫苗免疫效果的肠道微生物(Clinical and Translational Medicine, 2020)之后本年度取得的又一阶段性研究成果。
我校动科动医学院博士研究生隋保坤和武汉生命之美科技有限公司陈栋为论文共同第一作者,赵凌教授和武汉生命之美张翼博士为共同通讯作者。本研究得到国家重点研发计划、国家自然科学基金和校自主创新基金等经费的大力支持。
审核人:赵凌
论文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-020-02150-9

