(通讯员赵瑞亮、杨洋)近日,Cell Reports杂志在线发表了我校农业微生物国家重点实验室、生命科学技术学院微生物免疫团队解析CRISPR-cas系统免疫活性调控的最新研究成果。成果论文以“A membrane-associated DHH-DHHA1 nuclease degrades type III CRISPR second messenger”为题,首次鉴定金属依赖的、细胞膜关联的、降解III型 CRISPR-cas系统第二信使的核酸酶,研究表明,该酶可能参与调控III型系统的免疫活性,避免持续的免疫响应对细胞造成损害。
CRISPR-cas系统是原核生物用来抵御外来遗传元件入侵的获得性免疫系统。其中,III型 CRISPR-cas系统具有多种免疫活性,其效应复合物能够:(1) 切割crRNA匹配的靶标RNA;(2) 在结合靶标RNA时,切割转录泡周围的ssDNA;(3) 在结合靶标RNA时,合成第二信使——环寡聚腺苷酸(cOA);cOA能够结合下游效应物Csm6/Csx1,并激活后者高效切割非特异性ssRNA。此时不仅入侵核酸元件的转录本会受到降解,宿主转录本也会被切割,从而引起细胞休眠。III型系统所激活的核糖核酸酶活性需要受到严格的控制,否则会导致非预期的细胞毒性甚至细胞死亡。
2018年,英国M.F. White课题组发现一种含有CARF结构域、被称为环核酸酶的蛋白质能够以不依赖金属离子的方式切割cOA,并可能参与调控III型系统的免疫活性。然而,环核酸酶的活性不足以降解高浓度的cOA,而III型系统的效应复合物恰恰具有高效的cOA合成能力。这矛盾之处暗示存在未知因素参与III型系统免疫活性的调控。
2020年9月15日,华中农业大学韩文元课题组在Cell Reports杂志发表了标题为“A membrane-associated DHH-DHHA1 nuclease degrades type III CRISPR second messenger”的研究成果。该研究发现了降解cOA的新型核酸酶。该酶可能参与调控III型系统的免疫活性,避免持续的免疫响应对细胞造成损害。
作者首先从冰岛硫化叶菌的细胞提取物中鉴定出了金属离子依赖的、细胞膜关联的cOA降解活性,并发现在高cOA浓度下,金属依赖的cOA降解活性显著提高了清除cOA的效率。随后,作者分离得到了金属离子依赖的DHH-DHHA1家族核酸酶(MAD),并对其进行了一系列体内、体外研究。结果表明MAD具有三个特点:(1)具有极高的cOA降解能力;(2)结合在细胞膜上;(3)具有非特异性的DNA和RNA降解活性。
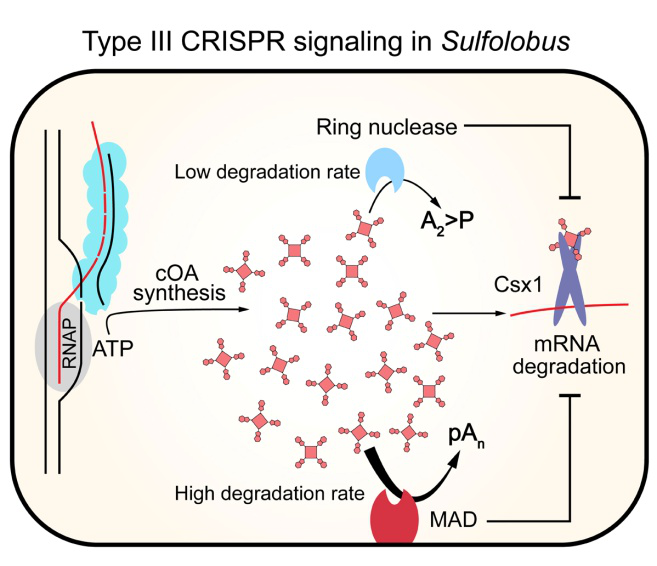
图1. 膜关联DHH-DHHA1核酸酶(MAD)参与调控III型系统免疫活性的工作模型
根据这些特点,作者提出了MAD的工作模型。病毒入侵引发III型CRISPR-cas系统的免疫响应,通过合成cOA激发Csx1的核酸酶活性。在cOA水平较低时,cOA主要由环核酸酶降解,而MAD的膜关联的特点会限制其对新生cOA的降解,从而避免过早关闭免疫响应;当cOA的浓度超过环核酸酶的降解能力时,扩散到细胞膜周围的cOA会被MAD快速降解,从而避免免疫响应持续太长时间对细胞造成损害。这些发现表明“聪明”的微生物能够复杂、精准地调控免疫响应,从而应对不同病毒入侵的情况,在与病毒的战争中存活。
生命科学技术学院硕士研究生赵瑞亮和杨洋为共同第一作者,韩文元教授为该研究的通讯作者。梁运祥教授和山东大学佘群新教授参与部分工作。该研究得到了校启动经费、国家自然科学基金、校自主创新基金的资助。
审核人:韩文元
论文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(20)31122-0

