南湖新闻网讯(通讯员 刘涛)近日,我校农业微生物学国家重点实验室暨湖北省洪山实验室彭楠教授课题组联合农业农村部沼气科学研究所何明雄研究院团队,揭示了细菌新型DNA损伤修复系统的工作规律,并结合细菌内源性CRISPR-Cas系统,建立了绿色生物制造重要底盘微生物运动发酵单胞菌和乳酸片球菌的高效基因组编辑工具。
图1 运动发酵单胞菌利用MMEJ途径区别修复CRISPR-Cas系统造成的基因组DNA和可移动元件的损伤
运动发酵单胞菌(Zymomonas mobilis)是一种能够在厌氧条件下直接利用ED途径代谢糖类产生乙醇的细菌,具有乙醇发酵速率高、乙醇耐受性好及生物安全等特点,在生物燃料应用方面具有巨大的应用价值。课题组研究发现CRISPR-Cas系统造成的基因组DNA损伤会被微同源介导的连接途径(MMEJ)高效修复,并造成部分DNA缺失。而MMEJ系统修复CRISPR-Cas造成的移动元件损伤的效率很低,代表了一种切割后区别自己和异己DNA的识别模式。该成果作为封面文章发表在Journal of Genetics and Genomics杂志上(图1),我校王晓婕博士生为论文共同第一作者。
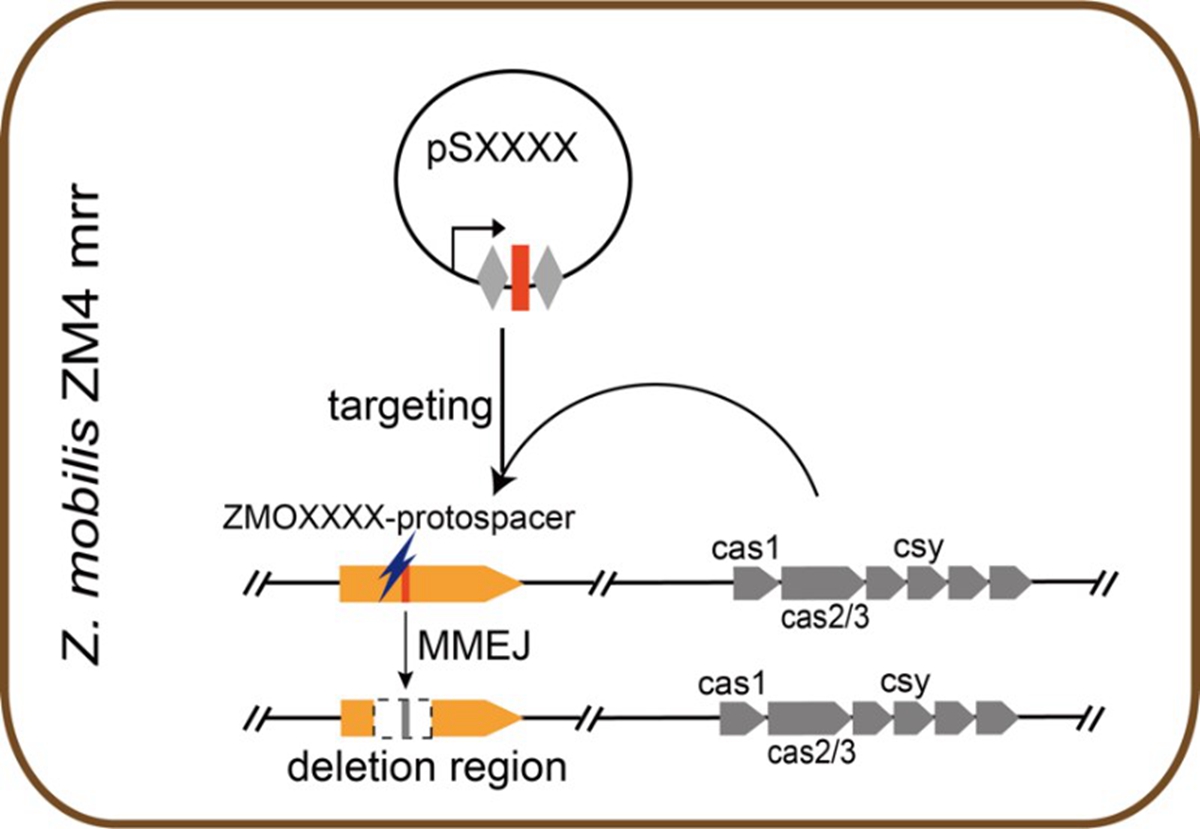
图2 基于内源性CRISPR-Cas系统和MMEJ途径的基因组快速编辑流程
在此基础上,课题组利用内源性CRISPR-Cas系统和MMEJ途径开发了一种适用于运动发酵单胞菌进行快速基因组编辑和必需基因鉴定的工具。该工具只需要构建一个带有mini-CRISPR(Repeat-Spacer-Repeat)的自靶向质粒即可实现靶基因和长片段的敲除(图2)。此外,通过改造mini-CRISPR的第二个重复序列(Repeat)进一步提高了该工具的编辑效率。该成果发表在Biotechnology for Biofuels杂志上,我校隋欣博士生为论文第一作者。
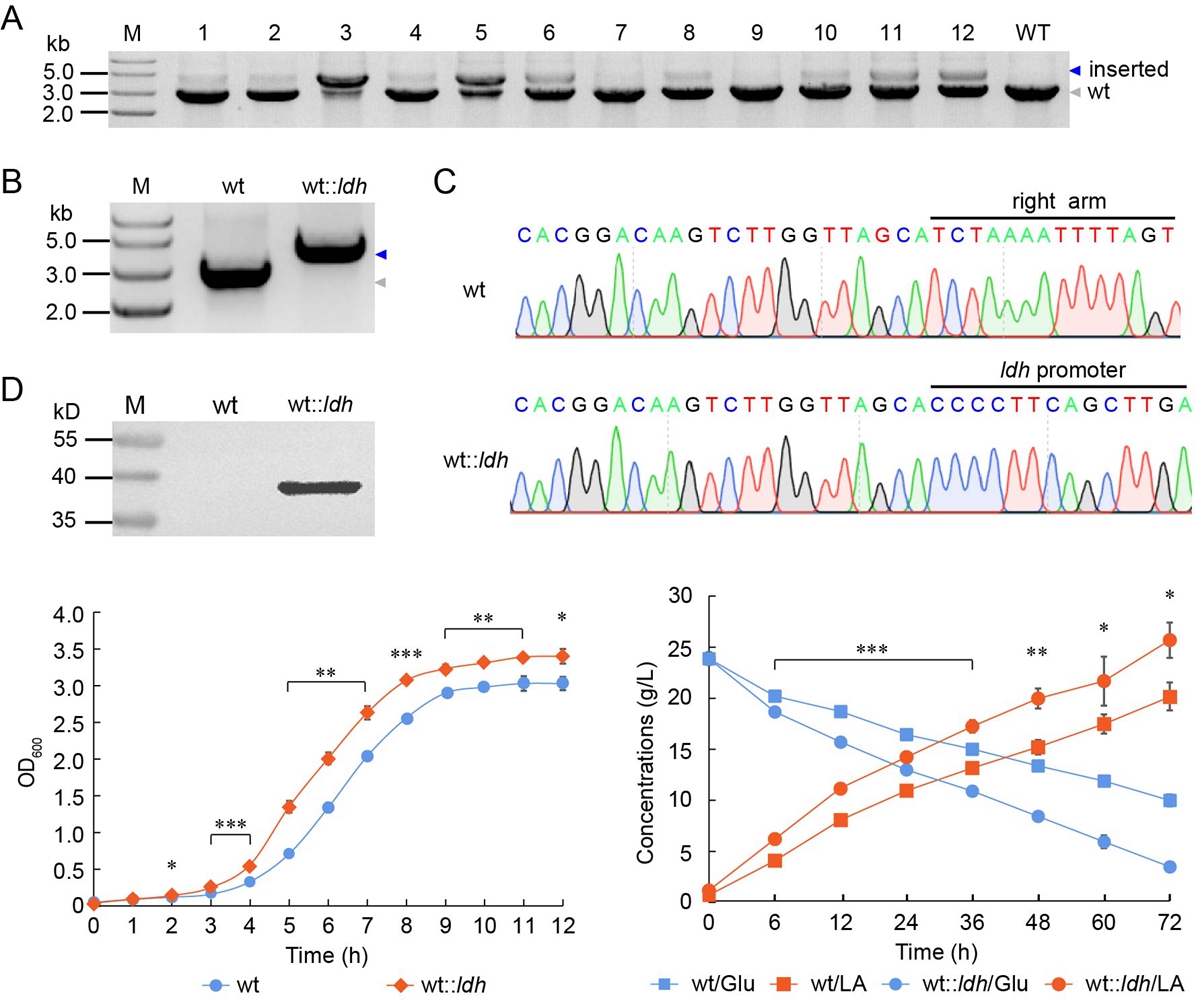
图3 整合表达乳酸脱氢酶基因显著提高乳酸片球菌的生长速率和乳酸生产速率
乳酸片球菌是饲料、医药目录内的重要益生菌,广泛地应用于乳酸和饲料发酵以及免疫调节等生产实践和临床治疗中。课题组前期分离到一株生产性能好、益生性能强的乳酸片球菌,发现其基因组编码CRISPR-Cas9系统。尽管该cas9基因发生无义突变,课题组研究表明其仍能行使核酸切割功能。基于该内源性CRISPR-Cas9系统,课题组建立了高效的遗传操作工具,实现了高效的基因敲除、点突变和整合。利用该技术消除内源性质粒和整合超表达乳酸脱氢酶基因显著提升了乳酸片球菌的生长速率及乳酸生产速率(图3)。该成果发表在Applied and Environmental Microbiology杂志上,我校刘玲博士生为论文第一作者,课题组获授权发明专利一项。该工作为益生菌合成生物学研究打下了坚实的基础。
审核人:彭楠
英文摘要
CRISPR-Cas systems provide bacteria and archaea with adaptive immunity against mobile genetic elements (MGEs) through uptake of invader-derived spacers. De novo adaptation samples spacers from both invaders and hosts, whereas primed adaptation shows higher specificity to sample spacers from invaders in many model systems as well as in the subtype I-F system of Zymomonas mobilis. Self-derived spacers will lead to CRISPR self-interference. However, our in vivo study demonstrated that this species used the microhomology-mediated end joining (MMEJ) pathway to efficiently repair subtype I-F CRISPR-Cas system-mediated DNA breaks guided by the self-targeting spacers. MMEJ repair of DNA breaks requires direct microhomologous sequences flanking the protospacers and leads to DNA deletions covering the protospacers. Importantly, CRISPR-mediated genomic DNA breaks failed to be repaired via MMEJ pathway in presence of higher copies of short homologous DNA. Moreover, CRISPR-cleaved exogenous plasmid DNA was failed to be repaired through MMEJ pathway, probably due to the inhibition of MMEJ by the presence of higher copies of the plasmid DNA in Z. mobilis. Our results infer that MMEJ pathway discriminates DNA damages between in the host chromosome versus mobile genetic element (MGE) DNA, and maintains genome stability post CRISPR immunity in Z. mobilis.
论文链接:https://doi.org/10.1016/j.jgg.2021.02.012

