近日,华中农业大学生物医学与健康学院教授金红林课题组与华中科技大学同济医学院教授杨坤禹课题组合作的研究成果在《今日纳米》(Nano Today)发表。研究搭建了一种多功能抗肿瘤水凝胶平台,用于开拓放射衍生物在抗肿瘤免疫治疗中的新用途。
免疫治疗,特别是针对程序性死亡-1(PD-1)/程序性死亡配体1(PD-L1)通路的免疫检查点阻断(ICB),已经改变了癌症的治疗范式。但临床数据显示,仅有一小部分患者(通常10-30%的应答率)对ICB有应答。这是由于在晚期癌症中,T细胞恢复和肿瘤负荷之间的不平衡是限制PD-1/PD-L1阻断治疗疗效的主要障碍之一。因此,能同时减轻肿瘤负荷和重塑肿瘤微环境(TME)的策略,可提高PD-1/PD-L1阻断治疗在晚期癌症患者中的临床疗效。
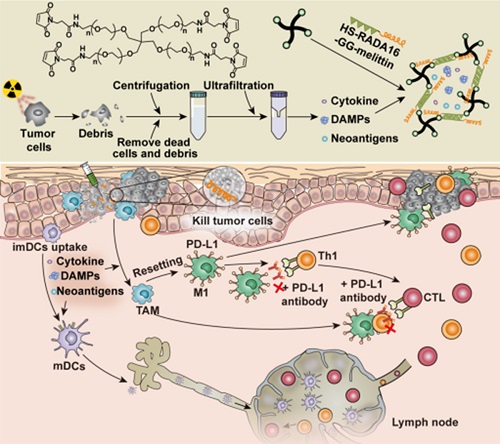
该研究发现,放疗后肿瘤细胞的超滤浓缩液(RT-UF)可高效刺激树突状细胞的活化和成熟。此外,RT-UF含有招募巨噬细胞的趋化因子,比如MIP-1, G-CSF, LIX和PF4等,可将巨噬细胞的表型极化为抗肿瘤的M1表型。RT-UF能有效地重塑TME,但由于其代谢过快且摄取效率低,导致其抗肿瘤作用不强。
为此,该团队自主研制了一种PEG和melittin-peptide(蜂毒肽)交联的治疗肽水凝胶,具有药物缓释,改善细胞膜通透性,快速诱导肿瘤细胞死亡等特性。基于此优势构建了超滤液负载的杂化蜂毒肽水凝胶(UF@MRP)用于高负荷肿瘤治疗。在多个ICB治疗不能有效控制的肿瘤模型中,瘤内给药UF@MRP可增强ICB疗效,延长生存时间。
数据表明,UF@MRP和抗PD -1单克隆抗体联用可治愈约43%的恶性腹水小鼠,且在治愈的小鼠上产生了强烈的免疫记忆效应。活体显微成像技术也证实,该联合治疗方式产生的抗肿瘤T细胞在细胞数量、运动活力和趋向性方面获得了较大的提升。更为重要的是,该治疗效应不依赖于RT-UF的肿瘤细胞来源,显示出广谱的抗肿瘤效应。
该研究发现了放疗超滤液具有较强免疫调节功能,可重塑肿瘤免疫微环境;通过优化的蜂毒肽水凝胶负载放疗超滤液,可发挥强效的抗肿瘤疗效应;以恶性腹水小鼠为模型,提出了一种“肿瘤间接放疗”的思路,实现了对局部晚期及广泛转移肿瘤的有效控制,具有较强的临床转化价值。
该研究受到了国家自然科学基金优秀青年基金项目的资助。

