南湖新闻网讯(通讯员 姚毅楠)12月17日,湖北洪山实验室、我校生物医学与健康学院、生命科学技术学院姚帆教授联合美国得州大学MD Anderson Cancer Center的马莉教授研究团队研究成果以“A targetable LIFR—NF-κB—LCN2 axis controls liver tumorigenesis and vulnerability to ferroptosis”为题于在Nature Communications在线发表。研究首次发现了肝癌中白血病抑制因子受体(leukemia inhibitory factor receptor,LIFR)的缺失激活NF-κB信号,进而上调铁螯合细胞因子LCN2,促进了肿瘤的发生发展,并导致肿瘤对铁死亡诱导药物的耐药性.该研究为安全、有效地靶向铁死亡治疗肿瘤提供了新的策略。
众所周知,肝脏在消化、解毒、免疫、造血 (主要在成人期以前)、储存和代谢稳态等诸多生物学功能中发挥了重要的作用,同时也受到众多致病因素的影响。肝癌患者5年生存率普遍低于20%,不幸的是,肝癌对化疗和放疗都不敏感。现阶段,临床中针对早期肝癌患者的治疗方式多为手术切除和移植,但对于大量肝功能不佳的晚期患者,只能进行系统性治疗。索拉非尼(sorafenib)是经FDA批准并广泛用于晚期肝癌治疗的一线药物,但仅能延长患者3个月左右生存期。目前为止,其他靶向药物Ⅲ期临床试验结果并未获得优于索拉非尼的治疗效果。近两年来,免疫检查点抑制剂联合抗血管生成抑制剂的治疗方案在临床试验中展现了喜人的效果,但这一增益现象仅在小部分病人中起作用。
早期的研究表明,铁死亡在抑制肿瘤进展中发挥了重要作用,然而靶向铁死亡的临床实践还面临着诸多局限。如何安全、高效地诱发肿瘤铁死亡是制约铁死亡诱导剂临床应用的关键。肝癌一线用药索拉非尼诱导肿瘤细胞凋亡的能力非常有限,却能促进癌细胞铁死亡。但是,最近有报导指出多种癌细胞对铁死亡诱导剂不敏感。因此,为了提高肝癌治疗的效果,姚帆教授与美国得州大学MD Anderson Cancer Center的马莉教授研究团队聚焦铁死亡,寻找靶向铁死亡,从而提高索拉非尼治疗效应的策略。
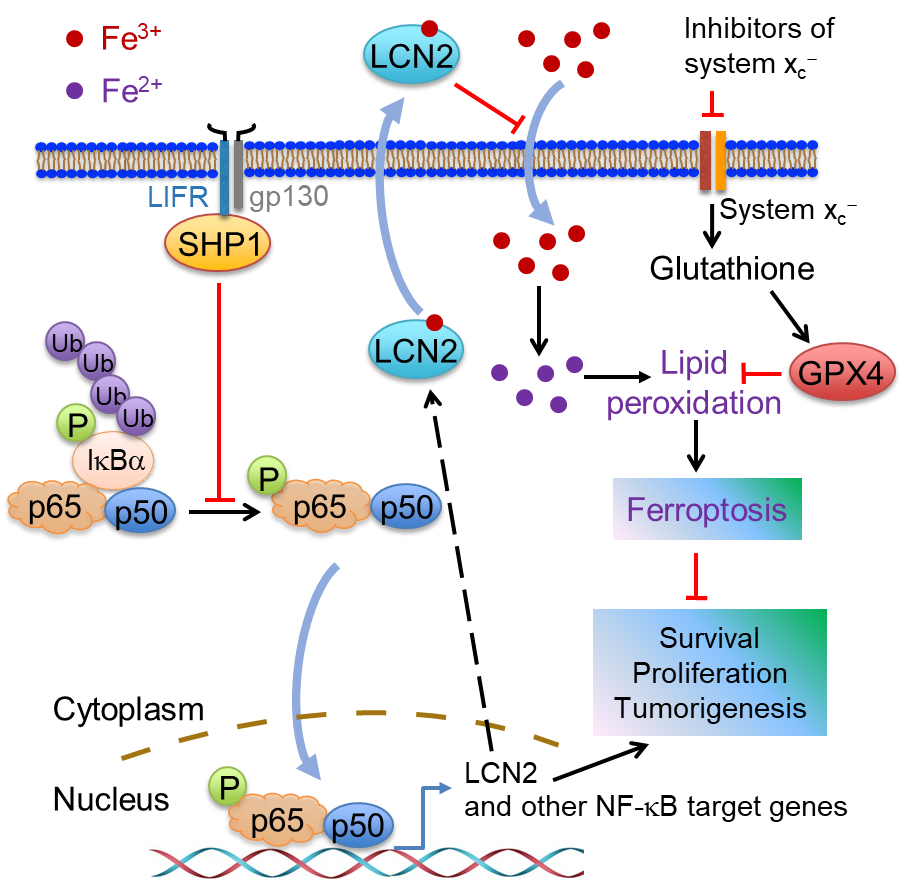
LIFR通过调控LCN2的表达促进肝细胞对铁死亡信号响应的机制模式图
研究发现,在Lifr肝细胞特异性和可诱导的敲除小鼠模型中,Lifr的缺失促进了肝癌的发生,并介导了对铁死亡诱导药物的耐受。进一步的分子机制表明,LIFR的缺失通过SHP1激活NF-κB信号通路,导致铁螯合因子LCN2的上调,从而促进细胞内铁离子的消耗,导致铁死亡耐受,最终影响肝癌的进展和治疗响应。值得注意的是,LCN2中和性抗体增强了索拉非尼对LIFR低表达(LCN2高表达)的肝癌PDX小鼠模型的铁死亡和抗肿瘤效应。因此,本项研究为肝癌的临床治疗提供了新的潜在生物标志物和作用靶标,为安全、有效地靶向铁死亡提供了新的策略。
马莉教授和姚帆教授分别为论文通讯作者和共同通讯作者,姚帆教授与邓雅岚博士为论文的第一作者和共同第一作者。近年来,姚帆教授课题组围绕营养与健康方向,利用CRISPR-Cas9激活型亚库联合小鼠肿瘤模型寻找提高肿瘤治疗效果的潜在靶标。在本工作的基础上,后续研究将继续深入探索针对肝癌临床治疗新方案的耐受机制。
审核人:姚帆
【英文摘要】
The growing knowledge of ferroptosis has suggested the role and therapeutic potential of ferroptosis in cancer, but has not been translated into effective therapy. Liver cancer, primarily hepatocellular carcinoma (HCC), is highly lethal with limited treatment options. LIFR is frequently downregulated in HCC. Here, by studying hepatocyte-specific and inducible Lifr-knockout mice, we show that loss of Lifr promotes liver tumorigenesis and confers resistance to drug-induced ferroptosis. Mechanistically, loss of LIFR activates NF-κB signaling through SHP1, leading to upregulation of the iron-sequestering cytokine LCN2, which depletes iron and renders insensitivity to ferroptosis inducers. Notably, an LCN2-neutralizing antibody enhances the ferroptosis-inducing and anticancer effects of sorafenib on HCC patient-derived xenograft tumors with low LIFR expression and high LCN2 expression. Thus, anti-LCN2 therapy is a promising way to improve liver cancer treatment by targeting ferroptosis.

