南湖新闻网讯(通讯员 杨若书)近日,我校作物遗传改良国家重点实验室、湖北洪山实验室玉米团队杨芳教授课题组与美国冷泉港实验室David Jackson教授及山东大学徐芳教授合作在Nature Plants在线发表了题为“Glutaredoxins regulate maize inflorescence meristem development via redox control of TGA transcriptional activity”的最新研究成果。该研究发现玉米中三个同源“CC-type”谷氧还蛋白(Glutaredoxins, GRX)通过调节bZIP转录因子FEASCIATED EAR4 (FEA4)的氧化还原稳态而影响其转录活性,进而调控幼穗花序分生组织的发育。这项研究揭示了玉米穗发育与形态建成中分子调控的新机制,也为ROS信号如何影响分生组织发育提供了新的见解。
玉米是重要的粮食作物,其产量受穗发育及形态建成的影响,研究调控此过程的关键基因及其作用机制具有重要的科学意义。植物分生组织发育过程中,维持细胞内氧化还原稳态对干细胞命运至关重要,此过程涉及一些关键基因功能的精细调控。谷氧还蛋白 (GRX) 可通过氧化还原和谷胱甘肽化修饰调控其靶蛋白的功能。然而,目前对GRX直接参与调控分生组织发育和活性的作用机理还知之甚少。
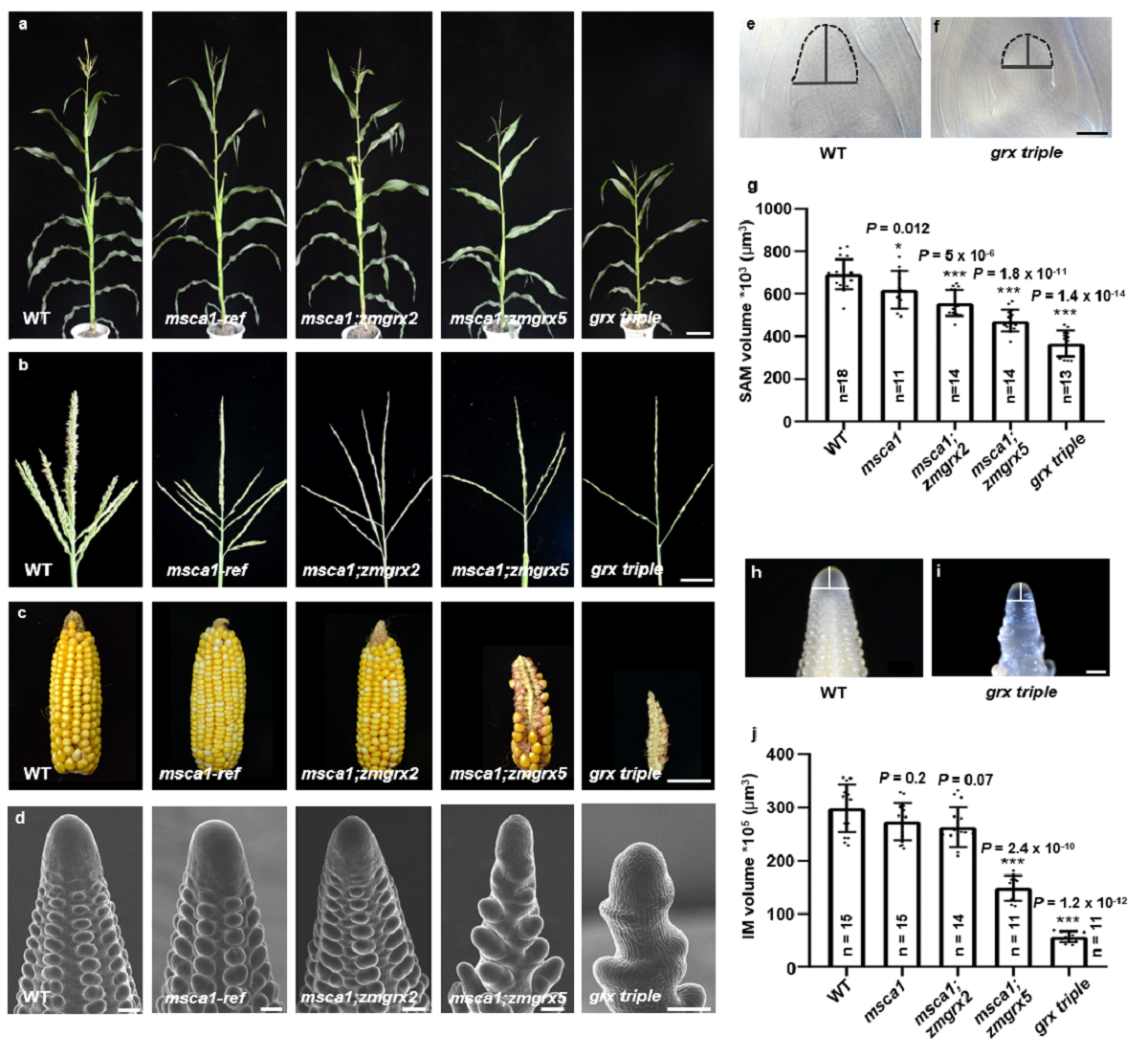
图1. MSCA1及其同源基因正向调控分生组织发育和穗形态建成
杨芳教授课题组与David Jackson教授及徐芳教授近期研究了玉米谷氧还蛋白MSCA1及其两个同源基因 (ZmGRX2、ZmGRX5) 调控穗发育的分子机制。三个同源基因存在较强的功能冗余,三突变体表现出花序分生组织活性显著降低,小穗发育与分化受阻,进而导致玉米单穗籽粒数显著下降(图1)。研究表明三个GRX蛋白的直接靶蛋白是一个负向调控花序分生组织发育的关键bZIP转录因子FEA4 (图2)。系列生化实验表明MSCA1可以作为电子供体直接还原FEA4,破坏其分子间二硫键,改变其单体/二聚体的平衡状态。更重要的是,三个GRX蛋白对FEA4的修饰直接影响了FEA4体内结合DNA的能力及其调控下游基因转录的能力。该研究成果揭示了三个GRX蛋白直接参与调控玉米花序分生组织发育的重要过程,阐明了其在穗发育和形态建成中的调控机制,并以崭新的视角探索了玉米穗发育过程中关键调控因子的氧化还原态变化对维持分生组织的活性的重要作用。研究成果既具有创新性,也为玉米穗型改良和高产分子育种提供了理论指导。
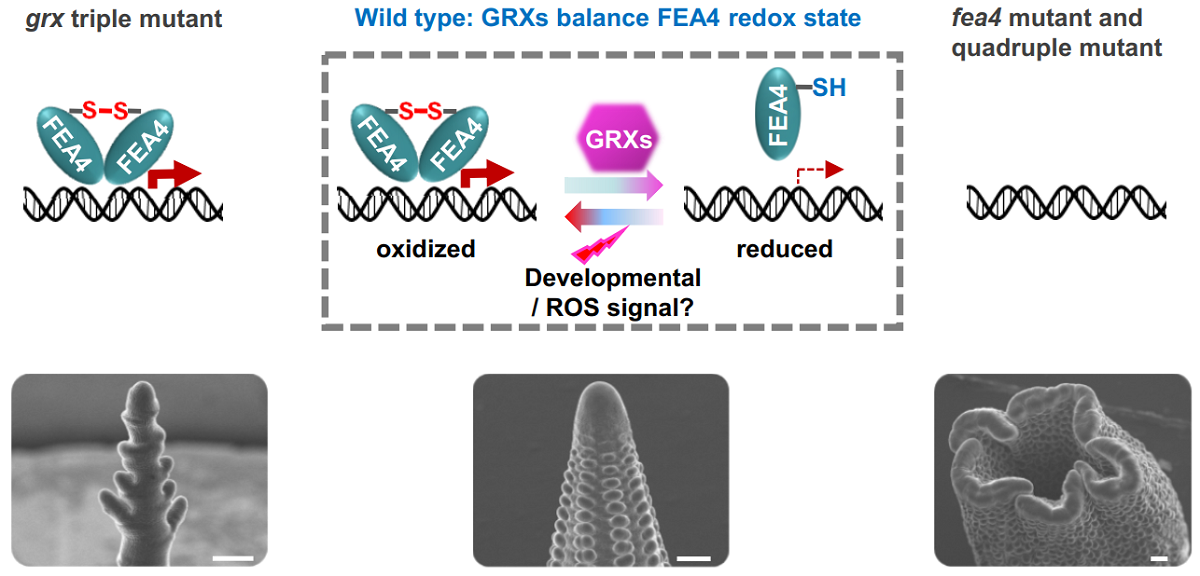
图2. 玉米三个GRX蛋白通过精细调控靶蛋白FEA4的氧化还原状态促进穗发育与形态建成
我校植物科学技术学院博士研究生杨若书、山东大学生命科学院徐芳教授为文章的共同第一作者,我校植物科学技术学院杨芳教授和美国冷泉港实验室教授David Jackson为共同通讯作者。该研究得到了国家自然科学基金、作物遗传改良国家重点实验室自主课题和华中农业大学自主科技创新基金等项目资助。
审核人:杨芳
【英文摘要】
Glutaredoxins (GRXs) are small oxidoreductases that can modify target protein activities through control of the redox (reduction/oxidation) state by reducing or glutathionylating disulfide bridges. Although CC-type GRXs are plant specific and play important roles in many processes, the mechanisms by which they modulate the activity of target proteins in vivo are unknown. In this study, we show that a maize CC-type GRX, MALE STERILE CONVERTED ANTHER1 (MSCA1), acts redundantly with two paralogues, ZmGRX2 and ZmGRX5, to modify the redox state and the activity of its putative target, the TGA transcription factor FASCIATED EAR4 (FEA4) that acts as a negative regulator of inflorescence meristem development. We used CRISPR–Cas9 to create a GRX triple knockout, resulting in severe suppression of meristem, ear and tassel growth and reduced plant height. We further show that GRXs regulate the redox state, DNA accessibility and transcriptional activities of FEA4, which acts downstream of MSCA1 and its paralogues to control inflorescence development. Our findings reveal the function of GRXs in meristem development, and also provide direct evidence for GRX-mediated redox modification of target proteins in plants.

