南湖新闻网讯(通讯员 邓利)近日,我校作物遗传改良国家重点实验室李兴旺教授课题组研究成果以“Diurnal RNAPII-tethered chromatin interactions are associated with rhythmic gene expression in rice”为题在Genome Biology发表。研究绘制了水稻昼夜动态变化的高分辨率三维基因组图谱,系统阐释了昼夜动态变化的三维基因组结构对节律基因转录调控的影响。
课题组前期系统地解析了水稻等模式植物不同组织的线性表观基因组和三维基因组结构这些相对“静态”的核内染色质组织形式。事实上,真核生物的三维基因组结构随时序(如昼夜节律 、 发育阶段等)发生动态变化,影响基因表达的种类和强度。因此,需要选择一个理想的系统,来研究三维基因组结构动态变化规律及其功能。地球自转产生的昼夜更替引起了光照和温度等环境的周期性变化,高等生物也演化出了与之相适应的内源性昼夜节律生物钟。生物钟产生以大约24 小时为周期的振荡变化,参与调控水稻中超过1/3活跃表达的基因,是生长发育、新陈代谢和激素信号传导等生命活动过程中重要的内源性基因表达调控系统。因此,水稻的节律钟生物学不仅本身是一个重要的研究领域,同时也是研究三维基因组结构动态变化与基因表达调控的理想模型。
ChIA–PET analysis defines the RNAPII interactome in rice during a circadian cycle
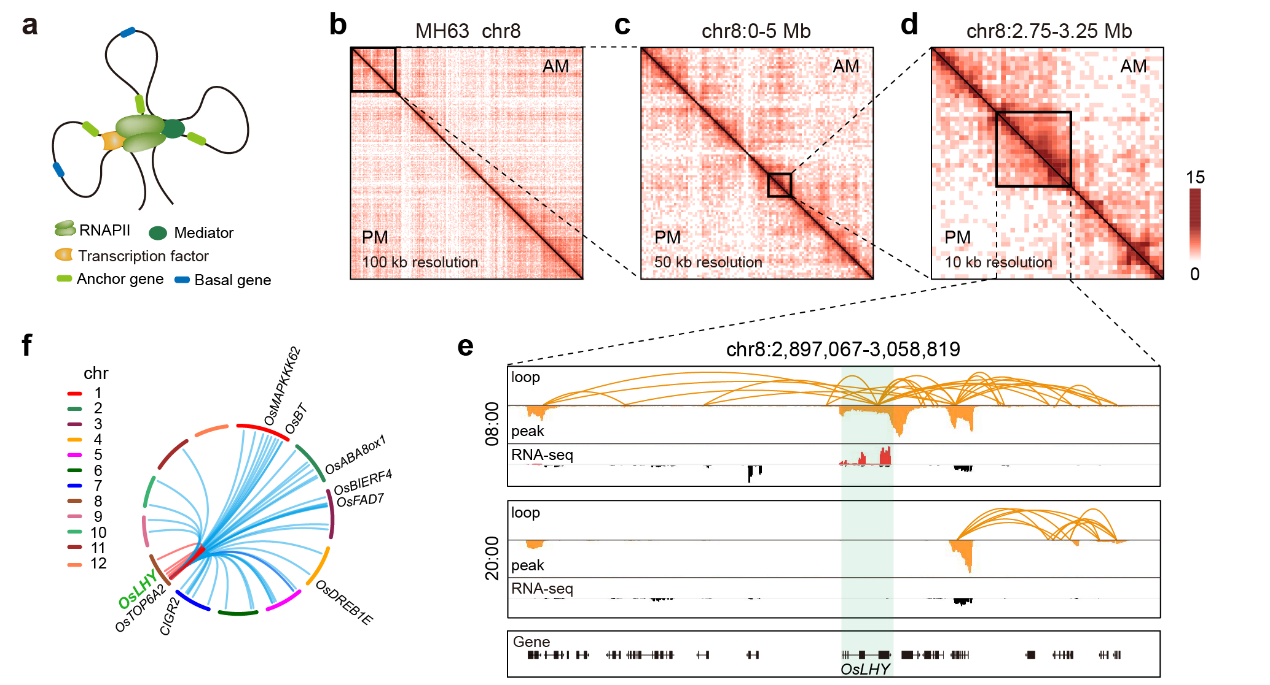
RNA聚合酶II(RNAPII)是真核生物基因转录的核心亚基,关键转录元件。在本研究中,首先绘制了RNAPII在一天中不同时间点的顺反组图谱,显示35%的RNAPII占位在一天中呈现节律变化,再结合节律转录组数据,发现RNAPII信号水平与节律基因的表达水平呈现显著正相关性,且RNAPII招募过程比mRNA积累提前2小时。随后,利用改进的Long-read ChIA-PET技术,构建了RNAPII介导的昼夜染色质交互图谱,系统分析了在不同的三维结构尺度下对节律基因转录的影响。
研究结果显示,在染色质环水平,RNAPII在早晚分别介导了20,667和21,001个染色质远程互作,其中32,697(91%)个远程交互是早晚特异的。且一天中相同或邻近相位的节律基因倾向于在空间上聚集在一起,进行协同表达。从同一个基因位点发出的染色质环形成染色质空间交互簇(CSC),研究发现节律表达基因倾向于富集在早上特异的CSC,而非节律基因倾向于富集在晚上特异的CSC。昼夜染色质交互网络分析表明,核心节律钟基因在早上均分布在RNAPII介导的染色质连接网络中,而在晚上则是分散开来、零星散布在较小的染色质连接网络中,这表明核心节律钟基因在早上彼此空间上相互接近进行协同转录,而在晚上则是位于离散的“转录工厂” 中。这些昼夜动态变化的水稻高分辨率三维基因组学研究和对节律基因的互作调控信息,有助于我们深入理解水稻不同空间尺度上DNA 顺式调控元件之间相互作用的节律变化规律,进而阐明其调控基因节律表达和重要农艺性状的机理,为水稻遗传改良和其他经济作物的研究提供重要的指导意义和科学价值。
华中农业大学博士后邓利和博士研究生高白白为论文共同第一作者。生命科学技术学院李兴旺教授为通讯作者,信息学院李国亮教授参与了课题指导。研究得到了国家重点研发计划、国家自然科学基金,中国博士后科学基金、中央高校基本科研专项资金以及作物遗传改良国家重点实验室自主课题等项目和基因组研究与水稻遗传改良创新团队的支持。
审核人:李兴旺
【英文摘要】
Background: The daily cycling of plant physiological processes is speculated to arise from the coordinated rhythms of gene expression. However, the dynamics of diurnal 3D genome architecture and their potential functions underlying rhythmic gene expression remain unclear.
Results: Here, we reveal the genome-wide rhythmic occupancy of RNA polymerase II (RNAPII), which precedes mRNA accumulation by approximately 2 h. Rhythmic RNAPII binding dynamically correlates with RNAPII-mediated chromatin architecture remodeling at the genomic level of chromatin interactions, spatial clusters, and chromatin connectivity maps, which are associated with the circadian rhythm of gene expression. Rhythmically expressed genes within the same peak phases of expression are preferentially tethered by RNAPII for coordinated transcription. RNAPII-associated chromatin spatial clusters (CSCs) show high plasticity during the circadian cycle, and rhythmically expressed genes in the morning phase and non-rhythmically expressed genes in the evening phase tend to be enriched in RNAPII-associated CSCs to orchestrate expression. Core circadian clock genes are associated with RNAPII-mediated highly connected chromatin connectivity networks in the morning in contrast to the scattered, sporadic spatial chromatin connectivity in the evening; this indicates that they are transcribed within physical proximity to each other during the AM circadian window and are located in discrete “transcriptional factory” foci in the evening, linking chromatin architecture to coordinated transcription outputs.
Conclusion: Our findings uncover fundamental diurnal genome folding principles in plants and reveal a distinct higher-order chromosome organization that is crucial for coordinating diurnal dynamics of transcriptional regulation.
论文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-021-02594-7

