南湖新闻网讯(通讯员 李姗)2022年3月25日,我校生命科学技术学院、生物医学与健康学院李姗教授实验室在Molecular Cell在线发表题为Pathogen hijacks programmed cell death signaling by arginine ADPR-deacylization of caspases的论文。文章报道了紫色色杆菌III型效应蛋白CopC能作用于宿主细胞多个caspase蛋白(caspase-3/-7/-8/-9),通过一种新型翻译后修饰抑制caspase的蛋白酶活性,从而调控多种程序性细胞死亡。该研究为开发防治紫色色杆菌感染相关疾病提供了新的药物靶点和理论基础。
许多革兰氏阴性致病菌通过其III型分泌系统(Type III Secretion System,T3SS)向宿主“注入”效应蛋白,来干扰宿主免疫信号通路,从而协助病原菌侵染。紫色色杆菌(Chromobacterium violaceum,C. violaceum)广泛存在于热带及亚热带地区土壤和水体中,感染人体尤其是免疫力低下的人群可引起严重的皮肤、肝、脾脓肿和坏死,感染进程快,致死率超过50%,其毒力依赖于它所拥有的两套Ⅲ型分泌系统:Cpi-1/-1a和Cpi-2。紫色色杆菌感染巨噬细胞时,其III型分泌系统装置中的针状蛋白CprI可通过激活NLRC4-caspase-1炎症小体引发细胞焦亡。但紫色色杆菌与上皮细胞死亡通路之间有怎样的调控关系,是科学家们关注的问题。
研究人员在利用C. violaceum感染上皮细胞并检测细胞死亡相关分子标志物时,发现caspase-3蛋白没有活化成活性的p17形式,而是大量停留在弱活性的p20形式,并且这种caspase-3 p20积累的现象,依赖于其III型分泌系统。通过筛选该细菌基因组中几乎所有已报道的III型效应蛋白,发现只有CopC可以通过抑制caspase-3/-7活性来调控细胞死亡。
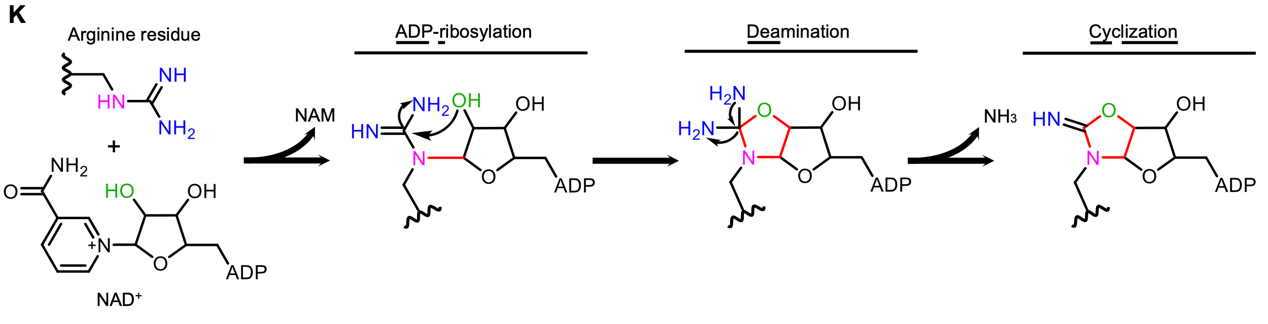
图1:CopC在钙调蛋白辅助下催化的新型蛋白质翻译后修饰ADPR-deacylization
为了研究CopC的作用机理,李姗教授团队通过鉴定底物修饰位点、分析修饰肽段二级质谱特征峰、体外重构CopC酶学反应、鉴定中间产物结构等逐步揭示CopC催化产生一种新型蛋白质翻译后修饰:CopC在辅助因子钙调蛋白CaM帮助下,利用NAD+为配体将ADP-核糖基团转移至caspase-3的第207位精氨酸(+541 Da),随即发生脱氨并介导环化(-17 Da),最终产生一个分子量变化为524 Da的新型蛋白质翻译后修饰,团队将其命名为“ADPR-deacylization”(图1)。
修饰位点R207直接参与caspase-3识别其底物切割序列DEVD,在caspase家族中高度保守,团队围绕CopC到底调控哪些类型细胞死亡过程展开研究,运用多种生物化学、细胞生物学手段揭示了CopC在调控细胞程序性死亡通路上展现出双面性:通过ADPR-deacylization修饰作用于caspase家族多个蛋白(caspase-3/-7/-8/-9),抑制细胞凋亡和细胞焦亡,并激活细胞坏死(图2)。

图2:紫色色杆菌效应蛋白CopC在感染中的作用机理
CopC在紫色色杆菌感染过程中对病原菌毒力至关重要。与此同时,CopC的同源蛋白广泛分布于自然界各种致病菌(如人类致病菌、植物致病菌、海洋动物致病菌等)及非致病菌中,表明CopC家族蛋白通过ADPR-deacylization修饰caspase家族蛋白进而调控细胞死亡信号通路是被病原菌广泛使用的一种新机制。
李姗教授为该文通讯作者,课题组博士研究生彭婷、陶新园和夏竹君为该论文的共同第一作者。实验室多位硕博士生参与了研究,湖北省十堰市太和医院中心实验室,感染与免疫性疾病研究所提供了质谱技术支持。李姗教授主要从事病原感染与免疫分子机制研究,“健康饮食-菌群-免疫”分子机制和人群队列研究,近年来共发表第一作者和通讯作者论文12篇,在研究“病原-宿主”互作机制过程中发现两种全新蛋白质翻译后修饰(Nature,2013;Molecular Cell,2022);解析催化机理(Molecular Cell,2019);制备研究工具并在多种病原菌中发现这些新型蛋白质修饰介导的致病机理(Angew. Chem. Int. Ed.,2014;Communications Biology,2020)。
原文链接:https://doi.org/10.1016/j.molcel.2022.03.010
审核:金安江

