南湖新闻网讯(通讯员 罗志辉)2022年6月17日,我校生命科学技术学院、生物医学与健康学院陈振夏团队联合武汉大学吴旻团队在Advanced Science在线发表题为Dynamic chromatin states coupling with key transcription factors in colitis-associated colorectal cancer的论文。该论文报道了AOM(偶氮甲烷)/ DSS(葡聚糖硫酸钠盐)炎症诱导小鼠结直肠癌模型在肿瘤发生过程中的染色质状态变化,并基于增强子的变化模式,鉴定出具有结直肠癌抑制作用的转录因子Otx2。该研究为结直肠癌发病机制提供了新的见解,并找到了具有治疗潜力的相关靶标转录因子。
AOM/ DSS小鼠是一种常用的炎症诱导结直肠癌模型。通过周期性药物注射,可以稳定、快速诱导肿瘤生成。本研究以该模型为基础,分别在AOM注射2、4、7和10周后对小鼠进行取样,然后对样本进行转录组和H3K27ac,H3K4me1,H3K4me3,H327me3和H3K9me3等五种组蛋白修饰的ChIP-Seq测序 (图1)。
图1.AOM/DSS小鼠建模和实验设计
首先,通过基因表达的样本聚类和信号通路分析,研究人员将5个时间点的实验小鼠分为了3种状态:正常、炎症和癌症。其中,处理0周为正常时期,2周和4周为炎症时期,7周和10周为癌症时期。炎症时期小鼠免疫功能被激活,并持续到癌症时期。癌症时期细胞循环、DNA复制和修复相关的肿瘤通路被激活。
然后,通过将多种组蛋白修饰联合分析,研究人员定义了小鼠肿瘤发生过程中的染色质状态。大部分表达活跃的基因富含活性调控元件增强子或启动子区域。并且,随着炎症发生,以及炎癌转化,增强子元件在基因组上的覆盖区域有所增加(图2)。因此研究人员将关注点重点放在增强子状态的染色质状态上,发现在肿瘤时期新增的增强子主要来源有静息状态和启动子状态。其中,静息状态到启动子状态转变与DNA复制和DNA修复相关,而由启动子转变为增强子的基因与线粒体功能相关。
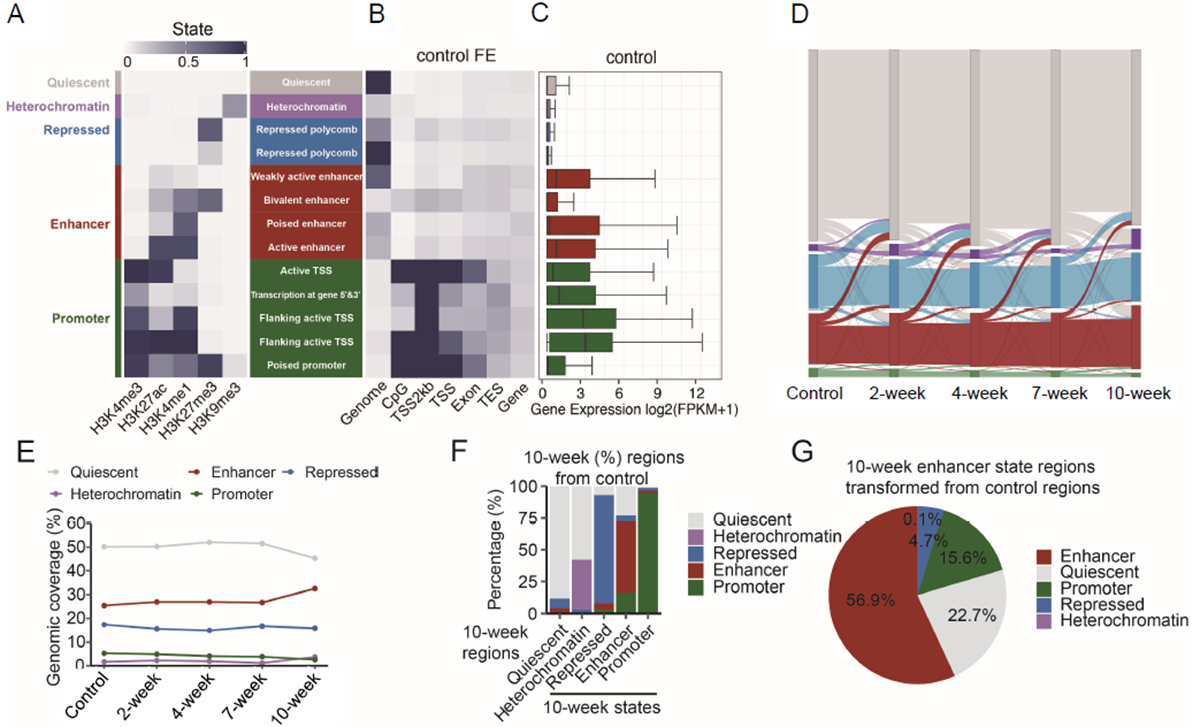
图2.AOM/DSS小鼠的染色质状态定义及其随时间的变化。
随后,研究人员分别对RNA和H3K27ac进行时间序列分析,发现新增的增强子与Wnt信号通路激活以及典型炎症通路NFκB相关,进一步表明增强子在炎癌转化过程中的核心作用。最后,研究人员通过对信号强度发生变化的增强子区域进行转录因子富集分析,鉴定并验证了转录因子Otx2具有结直肠癌抑制作用,为肿瘤研究提供了潜在的治疗靶点。
武汉大学吴旻教授和华中农业大学陈振夏教授为该文通讯作者。武汉大学陈林、华中农业大学罗志辉和武汉大学赵晨三位博士生为该文并列第一作者。目前,陈振夏团队已在结直肠癌的发生发展机制、性别差异和营养干预方面开展了多项研究,试图利用多组学方法,通过多学科交叉合作,阐明膳食-基因型-表型之间的关联及其机制,以达到精准营养治未病的目标。
【英文摘要】
Inflammation is one of the critical risk factors for colorectal cancer (CRC). However, the mechanisms for transition from colitis to CRC remain elusive. Recently, epigenetic changes have emerged as important regulatory factors for colitis-associated cancer. Here, a systematic epigenomic study of histone modifications is performed, including H3K4me1, H3K4me3, H3K27ac, H3K27me3 and H3K9me3, in an AOM-DSS-induced CRC mouse model. In combination with transcriptomic data, the authors generate a dataset of 105 deep sequencing files and illustrate the dynamic landscape of chromatin states at five time points during inflammation-cancer transition. Functional gene clusters are identified based on dynamic transcriptomic and epigenomic information, and key signaling pathways in the process are illustrated. This study's results reveal that enhancer state regions play important roles during inflammation-cancer transition. It predicts novel transcription factors based on enhancer information, and experimentally proves OTX2 as a critical tumor suppressive transcription factor. Taken together, this study provides comprehensive epigenomic data and reveals novel molecular mechanisms for colitis-associated cancer.
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202200536
审核人:陈振夏

